Chủ đề nóng
- Đăng nhập
- Đăng ký
- ×
Vui lòng đăng nhập hoặc đăng ký để gửi bình luận
Khi nhấn đăng nhập đồng nghĩa với việc bạn đã đồng ý với điều khoản sử dụng của báo Dân Việt
Đăng nhập
Họ và tên
Mật khẩu
Mã xác nhận

Khi nhấn đăng ký đồng nghĩa với việc bạn đã đồng ý với
điều khoản sử dụng của báo Dân Việt
Đăng ký
Xin chào, !
Bạn đã đăng nhập với email:
Đăng xuất
WHO: Hồ sơ kit xét nghiệm Covid-19 của Công ty Việt Á không đáp ứng yêu cầu về quản lý chất lượng
Mỹ Hằng
Thứ tư, ngày 22/12/2021 11:00 AM (GMT+7)
Trả lời các câu hỏi của Dân Việt về bộ xét nghiệm PCR do Công ty Việt Á sản xuất, đại diện Tổ chức Y tế Thế giới (WHO) tại Việt Nam đã cho biết thông tin, trong đó khẳng định Việt Á đã nộp hồ sơ tiền kiểm định tới WHO, song không đáp ứng đủ hồ sơ về an toàn, công năng và chất lượng.
Bình luận
0
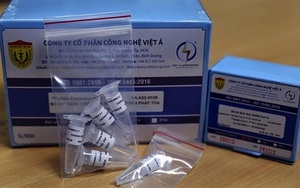
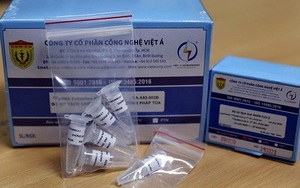
Sản phẩm không đủ điều kiện của WHO
Trả lời các câu hỏi của Dân Việt về bộ xét nghiệm PCR do Công ty Việt Á sản xuất, Văn phòng WHO tại Hà Nội cho biết: Bộ xét nghiệm PCR của Việt Á (LightPower iVASARS-CoV-2 1stRT-rPCR Kit) đã nộp hồ sơ tiền kiểm định cho chẩn đoán in vitro Covid-19 theo quy trình Danh mục sử dụng khẩn cấp (EUL) của WHO.
Mã hồ sơ đăng ký EUL của sản phẩm này là "EUL 0524-210-00". Hồ sơ sản phẩm đã được đánh giá và không đáp ứng được các hồ sơ cần thiết về an toàn, công năng và/hoặc QMS (tiêu chuẩn quản lý chất lượng)
Báo cáo công khai EUL của WHO về hồ sơ sản phẩm này có tại địa chỉ: https://extranet.who.int/pqweb/sites/default/files/documents/EUL_0524-210-00_LightPower_iVASARS-CoV-2_1stRT-rPCR-Kit.pdf

Ông Phan Quốc Việt - Tổng Giám đốc Công ty cổ phần Công nghệ Việt Á. Ảnh: P.V
Cụ thể, theo báo cáo của WHO về sản phẩm của Việt Á: Sản phẩm LightPower iVASARS-CoV-2 1stRT-rPCR Kit với mã VA.A02-055H, sản xuất bởi Công ty cổ phần Công nghệ Việt Á, địa chỉ 372A/8 Hồ Văn Huê, phường 9, quận Phú Nhuận, TP.Hồ Chí Minh, Việt Nam, không đủ điều kiện để mua sắm của WHO.
Để xác định tư cách hợp lệ cho việc mua sắm của WHO, Công ty Công nghệ Việt Á đã được yêu cầu cung cấp thông tin cập nhật về tình trạng của hệ thống quản lý chất lượng của họ.
Sau khi xem xét hồ sơ do Công ty cổ phần Công nghệ Việt Á gửi hỗ trợ cho việc đánh giá hệ thống quản lý chất lượng của nhà sản xuất, WHO đánh giá, thông tin đã nộp không tạo thành bằng chứng đầy đủ về việc tuân thủ ISO 13485: 2016 thiết bị y tế - hệ thống quản lý chất lượng - yêu cầu đối với các mục đích quy định và các yêu cầu được mô tả trong phần "Hướng dẫn về yêu cầu gửi: Chẩn đoán in vitro phát hiện axit nucleic SARS-CoV-2, PQDx_ 347".
Quy trình thẩm định minh bạch
Giải thích thêm về các quy trình thủ tục, WHO cho biết, cơ quan này có cơ chế tiền thẩm định để đánh giá sự an toàn chất lượng, hiệu quả của các sản phẩm y tế quan trọng, trong đó có sản phẩm chẩn đoán in vitro (trong ống nghiệm), thuốc men, vaccine, thiết bị tiêm chủng, thiết bị dây chuyền lạnh, sản phẩm kiểm soát vector.
Việc tiền thẩm định của WHO nhằm đảm bảo rằng các sản phẩm y tế quan trọng đáp ứng tiêu chuẩn toàn cầu về chất lượng, an toàn, hiệu quả, nhằm tối ưu hoá việc sử dụng các nguồn lực y tế và cải thiện sức khoẻ.
Quy trình tiền thẩm định cho mỗi dòng sản phẩm bao gồm đánh giá minh bạch, hợp lý về mặt khoa học, có thể bao gồm việc xem xét hồ sơ, thử nghiệm sản phẩm, đánh giá hiệu suất và kiểm tra các tổ chức nghiên cứu hợp đồng tại địa điểm sản xuất.
Đầu ra của việc tiền thẩm định bao gồm danh sách các sản phẩm đã được thẩm định, danh sách các phòng thí nghiệm kiểm tra chất lượng đã được tiền thẩm định và các báo cáo đánh giá và kiểm tra công khai của WHO. Những danh sách và báo cáo này được LHQ và các cơ quan mua sắm khác sử dụng để thông báo cho các quyết định mua hàng của họ liên quan đến các sản phẩm sức khỏe.
Danh mục sử dụng khẩn cấp
WHO cũng đã phát triển quy trình Danh mục sử dụng khẩn cấp (EUL) để tận dụng sự sẵn có của các sản phẩm y tế quan trọng (vaccine, chẩn đoán trong ống nghiệm, v.v...) cần thiết trong tình huống khẩn cấp về sức khỏe cộng đồng.
Quy trình nhằm hỗ trợ các cơ quan mua sắm và các quốc gia thành viên đưa ra các quyết định của họ về tính phù hợp để sử dụng một sản phẩm chẩn đoán in vitro cụ thể, dựa trên một tập hợp tối thiểu các dữ liệu về chất lượng, an toàn và hiệu suất có sẵn.
Ngày 30/1/2020, Tổng Giám đốc WHO tuyên bố rằng sự bùng phát Covid-19 là một tình trạng khẩn cấp về y tế công cộng cần sự quan tâm của quốc tế và vào ngày 11/3/2020, nó được coi là một đại dịch.
Việc đảm bảo chất lượng, an toàn và công năng của IVD là một phần quan trọng trong chiến lược tổng thể để kiểm soát đại dịch.
Danh sách sử dụng khẩn cấp của WHO mở cho chẩn đoán in vitro (IVD) Covid-19 vào ngày 28/2/2020.
WHO công bố các báo cáo công khai cho cả sản phẩm IVD được phê duyệt thông qua quy trình EUL của WHO và các sản phẩm không đủ điều kiện cung ứng tại trang web: https://extranet.who.int/pqweb/vitro-diagnostics/coronavirus-disease-covid-19-pandemic-%E2%80%94-emergency-use-listing-procedure-eul-open
Tính đến ngày 20/12, đã có 28 sản phẩm IVD Covid-19 được chấp thuận thông qua quy trình EUL của WHO. Danh sách có sẵn tại đây: https://extranet.who.int/pqweb/sites/default/files/documents/211125_EUL_SARS-CoV-2_products_list.pdf
46 sản phẩm IVD khác không đáp ứng được các hồ sơ cần thiết về an toàn, công năng và/hoặc hệ thống quản lý chất lượng (QMS); các hồ sơ này đã bị rút lại hoặc không đáp ứng các tiêu chí đánh giá của EUL. Danh sách có sẵn tại đây: https://extranet.who.int/pqweb/sites/default/files/documents/211210_List_IVDs_NotAccepted_EUL_SARS-CoV-2.pdf
Tin cùng chủ đề: Công ty Việt Á nâng khống giá kit test Covid-19
- Công an làm việc với Giám đốc CDC Đắk Lắk về việc mua kit test của Công ty Việt Á
- Vụ Giám đốc CDC Bình Phước “nhận quà” của Công ty Việt Á: Cán bộ Sở Y tế làm việc với Bộ Công an
- Đại biểu Quốc hội: Việt Á chi “hoa hồng” gần 800 tỷ đồng, thật khủng khiếp nhưng số tiền có thể lớn hơn
- Bình Dương lên tiếng về việc mua 6 máy xét nghiệm PCR giá hơn 23 tỷ đồng của Công ty Việt Á
Mời các bạn đồng hành cùng báo Dân Việt trên mạng xã hội Facebook để nhanh chóng cập nhật những tin tức mới và chính xác nhất.
Tin cùng chuyên mục
Xem theo ngày
Xem
Tin nổi bật